De rol van AI in de zoektocht naar medicijnen voor zeldzame ziektes
AI heeft vele gezichten. Van alle AI-tools in het nieuws, behoren de ‘Generatieve AI’-systemen (zoals ChatGPT), die nieuwe content kunnen maken, tot de al wat langer bestaande ‘discriminative’ of ‘analytische’ AI. AI die bestaande data analyseert op basis van een model en daar voorspellingen uit kan halen. Maar AI zit ook in allerlei systemen voor beeldherkenning, vertalingen en samenvattingen. Je ziet dat verschillende organisaties kijken hoe ze het kunnen gebruiken.
In dit artikel probeer ik uit te leggen hoe zo’n AI-systeem nu eigenlijk in elkaar zit, zonder daarbij heel erg in de details te gaan. Ik doe dit naar aanleiding van een voorbeeld dat ik onlangs hoorde van het farmaceutische onderzoeksbedrijf AbbVie. Zij gebruiken AI om bij zeldzame ziektes te kijken of er bestaande medicatie is die gebruikt kan worden in de behandeling, de zogenaamde ‘off target use‘.
Clinical trials
Het ontwikkelen van een nieuw medicijn voor een aandoening of ziekte is iets wat miljarden euro’s kost en jaren kan duren. Tussen de 10 en 15 jaar is niet ongewoon. Daarnaast wordt ongeveer tussen de 10-15% van de medicatie, die door de zogenaamde eerste fase van de clinical trials gaat, toegelaten tot de markt. Deze zogenaamde clinical trials zijn verplicht om te zorgen dat de medicatie veilig is en dat het ook werkt.
In dit proces wordt er heel veel documentatie opgeleverd en beschreven. Medicatie die is toegelaten tot de markt zou, naast waar het voor bedoeld is, nog een andere werking kunnen hebben. Dit soort onderzoek staat steeds meer in de belangstelling om te kijken of de bestaande veilige medicatie kan worden gebruikt voor iets wat ze ‘off target use’ noemen.
Een voorbeeld is Minodoxil, oorspronkelijk tegen hoge bloeddruk, maar nu te gebruiken als haargroeimiddel. Het gaat hierbij zowel om bestaande toegelaten medicatie, als medicatie die niet heeft gewerkt voor waar het oorspronkelijk voor bedoeld was. Dat gaf dan niet het gewenste resultaat.
Zeldzaam
Zeldzame aandoeningen zijn, zoals de naam al zegt, zeldzaam. Om heel specifiek te zijn, gaat het om een groep van aandoeningen waarbij het aantal patiënten minder is dan 50 op de 100.000 mensen. In de Verenigde Staten gaat het trouwens om 60 op de 100.000.
Deze aandoeningen staan beschreven op de site van Orphanet waar je kunt zoeken wat een bepaalde aandoening precies is.
In dit geval gaat het over Carney complex, waarvan maar 750 bekende gevallen ter wereld zijn. Als je een zeldzame ziekte of aandoening hebt, is de kans dat er een medicijn voor ontwikkeld wordt klein. Voor Duchenne Muscular Dystrophy (9/10 gevallen op 100.000) heeft Prosensa geprobeerd een medicijn te ontwikkelen, maar helaas gaf dit niet de gewenste verbetering. Bij Carney complex is de kans 0 dat er een specifiek medicijn wordt ontwikkeld.
Van ongestructureerd naar gestructureerd
AbbVie heeft samen met hun partner Tellic een zogenaamde ‘knowledge graph‘ gemaakt. Ze hebben meer dan 53 miljoen documenten uit het Life Science-onderzoek, naar nieuwe medicijnen ingevoerd in een LLM. De ongestructureerde data werd opeens gestructureerd. Dit komt omdat een LLM kennis heeft van taal en dus taal kan interpreteren.
Knowledge graph
Door deze kennis op te bouwen waren ze in staat om, zoals gezegd, een knowledge graph te maken van maar liefst 911 miljoen edges (relaties tussen knooppunten).
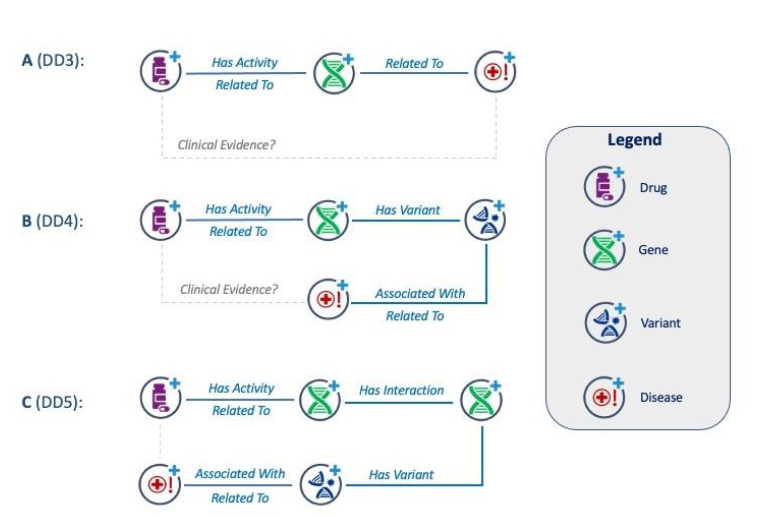 Daarbij brachten ze relaties in kaart tussen drug, gene, variant en disease. Het document is online te vinden. Het is niet peer reviewed omdat de algoritmes die worden gebruikt niet gedeeld kunnen worden.
Daarbij brachten ze relaties in kaart tussen drug, gene, variant en disease. Het document is online te vinden. Het is niet peer reviewed omdat de algoritmes die worden gebruikt niet gedeeld kunnen worden.
Het opbouwen van het model is een complexe business. Maar het principe is dat hoe meer relevante meldingen je kunt vinden over een drug, gene, disease en variant, hoe groter de kans dat dit echt zo is en klinisch is bewezen.
Door toen gericht te gaan queryen en te kijken naar welke andere medicatie zou kunnen werken bij Carney complex, kwam naar voren dat een medicijn (Ruxolitinib) geschikt zou kunnen zijn voor de behandeling van Carney complex. Ruxolitinib is een proteïne kinase remmer die het signaal voor kankercellen om te multipliceren remt.
Potentiële patiënt
De medicatie is al toegelaten op de markt en daardoor is de stap om deze medicatie voor te schrijven aan een patiënt veel eenvoudiger. In de meeste gevallen moet een commissie in het ziekenhuis toestemming geven om dit medicijn voor deze zogenaamde ‘off target’-toepassing aan de patiënt voor te schrijven.
Kan dit in Nederland ook?
Ja, het is toegestaan onder voorwaarden om ‘off target’, of zoals het in het Nederlands heet ‘off-label’, voor te schrijven voor een andere ziekte of aandoening. Dus in theorie zou ook een Nederlandse patiënt met Carney complex baat kunnen hebben bij de resultaten die AbbVie heeft geboekt.
Moraal van dit verhaal
Wat is nu het mooie aan dit verhaal? Met name het moment dat je het hebt over zeldzame ziektes (bijvoorbeeld Carney complex, dat met 750 patiënten wereldwijd heel zeldzaam is) en dat er iets is dat hoop geeft die er anders niet zou zijn.
De kosten die gepaard gaan met de ontwikkeling van medicatie voor heel zeldzame ziektes, maken het onmogelijk deze terug te verdienen. Dit is, omdat de ontwikkelingskosten (miljarden euro’s) medicatie zou opleveren die letterlijk niet te betalen is.
Dure medicatie kan na de toelating op de markt door de Minister van Volksgezondheid, Welzijn en Sport in de zogenaamde ‘sluis’ worden geplaatst. De sluis voor dure geneesmiddelen is er voor medicijnen en behandelingen die per patiënt heel duur zijn. Of die per jaar in totaal heel veel gaan kosten, omdat veel patiënten ze nodig hebben.
Criteria voor de sluis
De criteria voor de sluis zijn wettelijk vastgelegd. Die zijn:
- Een medicijn dat €20 miljoen of meer per jaar kost om in heel Nederland te gebruiken bij 1 of meerdere nieuwe indicaties.
- De kosten van een medicijn bij 1 indicatie zijn per jaar €10 miljoen of meer.
- Het gebruik per patiënt per jaar is €50.000 of meer.
Sluisgeneesmiddelen worden door Zorginstituut Nederland beoordeeld op:
- Noodzakelijkheid: zijn de gevolgen van de ziekte zo groot dat medicijnen nodig zijn?
- Effectiviteit: hoe goed werkt het medicijn ten opzichte van de medicijnen die al vergoed worden in Nederland?
- Kosteneffectiviteit: is de prijs van het medicijn redelijk voor wat het de patiënt en de samenleving oplevert?
- Uitvoerbaarheid: is opname in het basispakket uit te voeren in de praktijk?
Daaruit komt een advies dat naar de minister toegaat. Als dit positief is, kan het proces verder worden doorlopen. Hierbij is het mogelijk om een prijsonderhandeling te hebben met de fabrikant. Al met al is dit een proces wat moet worden doorlopen, waar tijd in gaat zitten én waarbij er heel duidelijke criteria zijn zoals hierboven beschreven.
Meer mensen kunnen helpen
De doorslaggevende factoren zijn effectiviteit en kosteneffectiviteit. In Nederland zijn we bereid veel geld te betalen voor een nieuw geneesmiddel dat echt werkt. Veel middelen maken in de praktijk hun belofte bij toelating niet waar en met het beschikbare geld (waar iedereen boven de 18 jaar aan meebetaalt) wil je zoveel mogelijk toegang tot goede zorg voor iedereen regelen.
Bij het huidige onderzoek wordt gekeken of bestaande medicatie bruikbaar is voor andere aandoeningen. Dit geeft mogelijk hoop voor patiënten met aandoeningen of ziektes waar op dit moment geen medicijn voor bestaat.
Maar AbbVie gaat verder en zal in de toekomst meer publieke onderzoeksdata verwerken tot knowlegde graphs, om zo nog meer mensen te kunnen helpen.




![Slimme linkbuilding-strategieën om autoriteit & vertrouwen op te bouwen [stappenplan]](https://www.pharmamarketeer.nl/wp-content/uploads/2025/04/big-data-domain-web-page-seo-concept-2025-02-10-05-57-46-utc-1-385x300.jpg)





